Èsteres: son compuestos orgánicos en los cuales un grupo orgánico (simbolizado por R' en este artículo) reemplaza a un átomo de hidrógeno (o más de uno) en un ácido oxigenado.
Nomenclatura
La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:
- La primera parte del nombre, etanoato (acetato), proviene del Acido etanoico (acético)
- La otra mitad, de metilo, proviene del alcohol metílico (metanol).
En el dibujo de la derecha se observa la parte que procede del ácido (en rojo; etanoato) y la parte que procede del alcohol (en azul, de etilo).
Luego el nombre general de un éster de ácido carboxílico será "alcanoato de alquilo" donde:
- alcan-= raíz de la cadena carbonada principal (si es un alcano), que se nombra a partir del número de átomos de carbono. Ej.:Propan- significa cadena de 3 átomos de carbono unidos por enlaces sencillos.
- oato = sufijo que indica que es derivado de un ácido carboxílico. Ej: propanoato: CH3-CH2-CO- significa "derivado del ácido propanoico".
- de alquilo: Indica el alcohol de procedencia. Por ejemplo: -O-CH2-CH3 es "de etilo"
En conjunto CH3-CH2-CO-O-CH2-CH3 se nombra propanoato de etilo.
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrogenos como aceptadores, pero no pueden participar como dadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como dador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre molèculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
- butanoato de metilo: olor a Piña
- Salicilato de metilo (aceite de siempreverde o menta): olor de las pomadas Germolene y Ralgex (Reino Unido)
- Octanoato de heptilo: olor a frambuesa
- etanoato de pentilo: olor a plàtano
- pentanoato de pentilo: olor a manzana
- butanoato de pentilo: olor a pera o a albaricoque
- etanoato de octilo: olor a naranja
Los ésteres también participan en la hidròlisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por àcidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxilico, o una sal de un ácido carboxílico.
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas
HALOGENUROS DE ACILO.
Los compuestos derivados de los ácidos carboxilicos presentan un sustituyente que contiene oxígeno, nitrógeno o un átomo de halógeno unido al doble enlace carbono-oxígeno. Estos derivados son compuestos en los que el -OH de un grupo carboxilico ha sido reemplazado.NOMENCLATURA.
Los halogenuros de acilo, que también se llaman halogenuros de ácido, se nombran de acuerdo con el sistema UIPAC y también en el sistema común, substituyendo la palabra ácido por la palabra halogenuro, según el halógeno correspondiente, y cambiando la terminación ico del ácido por ilo. La posición de los substituyentes se indica en igual forma que en el caso de los ácido; en el sistema de la IUPAC se emplean números y en el sistema común, letras griegas.
PROPIEDADES FISICAS Y QUIMICAS
Los halogenuros de acilo no tienen hidrógenos ácidos, no se asocian por puentes de hidrógeno y tienen puntos de ebullición menores que los ácidos de los que provienen. Son solubles en la mayoría de los disolventes orgánicos y tienen olores irritantes que posiblemente se deban a que reaccionan fácilmente con la humedad del aire y experimentan la hidrólisis a fin de producir el ácido clorhídrico. Los halogenuros de acilo se hidrolizan con agua produciendo el ácido correspondiente. Frecuentemente esta reacción es exotérmica y muy rápida. Los halogenuros de ácidos aromáticos no reaccionan muy rápidamente con agua, a temperatura ambiente. Esto se debe, probablemente, a que la carga positiva sobre el carbono del acilo se puede dispersar, en parte, en el anillo aromático. Por lo que, el átomo de carbono del acilo de un halogenuro aromático es menos electrofílico que el de un halogenuro alifático.
Los alcoholes primarios y secundarios reaccionan fácilmente con los halogenuros de ácido formando ésteres. Este método es excelente para la preparación de ésteres.
Los alcoholes terciarios reaccionan con los halogenuros de acilo, en presencia de una base o un metal activo, tal como magnesio, produciendo ésteres. En ausencia de la base o del metal, los halogenuros de ácido transforman los alcoholes terciarios en alquenos o halogenuros de alquilo terciarios. Los halogenuros de acilo también reaccionan con los fenoles produciendo ésteres; los fenoles tienen un grupo oxhidrilo directamente unido a un anillo aromático.
Los halogenuros de ácido reaccionan con el amoníaco y también con aminas primarias y secundarias produciendo amidas.
Los ácidos reaccionan con halogenuros de ácido, en presencia de piridina, produciendo anhídridos. Los halogenuros de ácidos reaccionan con peróxido de sidio formando peróxidos orgánicos. Los peróxidos de acilo son inestables y se descomponen fácilmente produciendo radicales libres. Por esta razón los peróxidos de acilo se emplean como iniciadores de reacciones por radicales libres. Los reactivos organometálicos son fuertemente neuclofílicos y es de esperarse que reaccionen con los halogenuros de ácido. Aunque se han empleado reactivos organometálicos de muchos metales distintos para hacerlos reaccionar con los halogenuros de ácido, los más usados son los organocádmicos, los cuales reaccionan con halogenuros de ácido produciendo cetonas.
El fosgeno puede considerarse un cloruro de ácido derivado del ácido carbónico, H2CO3. El fosgeno se prepara mediante la reacción entre monóxido de carbono y cloro.
Anhídrido
Los anhídridos de ácido (o anhídridos carboxílicos) son compuestos quimicos organicos que tienen la formula general (RCO)2O, y formalmente son el producto de deshidratacion de dos moléculas de ácido carboxilico (o una si tiene lugar de forma intramolecular en un ácido dicarboxílico). Al reaccionar con agua (hidrolisis) vuelven a formar los ácidos carboxílicos de partida.
Nomenclatura
Se nombran, en general igual que los ácidos de procedencia precedidos de la palabra anhídrido:- Los anhídridos de ácido dicarboxílicos (un acido) se nombran sustituyendo la palabra ácido por anhídrido.
- Los anhídridos de ácido monocarboxílicos se nombran con la palabra anhídrido seguido de cada componente del ácido carboxílico en orden alfabético (sin la palabra ácido).
Para Nombrar
- Reconocer la cadena principal que pertenece al grupo funcional anhídrido (O).
- Dar el nombre de los ácidos carboxílicos de origen suprimiendo la palabra ACIDO.
- Debemos recordar que para numerar los radicales siempre debemos hacerlo empezando por el carbono que este unido al grupo funcional.
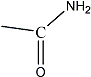
Una amida es un compuesto orgánico cuyo grupo funcional es de tipo RCONRlRll, siendo CO grupo funcional carbonilo, N un átomo de nitrógeno, y R, Rl, Rll radicales orgánicos o átomos de hidrogeno.
Propiedades físicas:
- A excepción de la amida más sencillas (la formamida), las amidas sencillas son todas sólidas y solubles en agua, sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes
- Casi todas las amidas son incoloras e inodoras
- Son neutras frente a los indicadores
- Los puntos de fusión y ebullición de las amidas secundarias son bastante menores
- Por su
parte , las amidas terciarias no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y ebullición deacuerdo con supeso molecular
Hecho por: LUZ MILAGRO REINA B, JULIETH ROMERO Z, AMPARO PINTO V.








No hay comentarios:
Publicar un comentario